Download our appand get started for free
Experience the future of education. Simply download our apps or reach out to us for more information. Let's shape the future of learning together!No signup needed.*
Similar Questions
- 1પ્રક્રિયામાં $NaOH + {H_3}P{O_4} \to Na{H_2}P{O_4} + {H_2}O$ ફોસ્ફોરિક એસિડ $({H_3}P{O_4})$ નું તુલ્ય વજન $ ({H_3} P {O_4}) $ .... છે?View Solution
- 2${K_2}C{r_2}{O_7}$ ની $N{a_2}{S_2}{O_3}$ દ્વારા સ્ટાન્ડર્ડાઇઝેશન કરવાની આયોડોમેટ્રી દરમ્યાન ${K_2}C{r_2}{O_7}$નો તુલ્યભાર કેટલો થાય ?View Solution
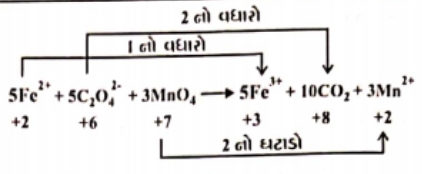
- 3$MnO_4^- + 5Fe^{2+} + 8H^+ \rightarrow Mn^{2+} + 5Fe^{3+} + 4H_2O$ ઉપરોક્ત પ્રક્રિયામાં $x$ અને $y$View Solution
- 4આપેલ પ્રક્રિયા માટે $A, B, C, D$ પસંદ કરો. $Zn\left( s \right) + 2HCl \longrightarrow ZnC{l_2} + {H_2}$View Solution
- 5આપેલ પ્રક્રિયા માટે $A, B, C, D$ પસંદ કરો. ${K_2}Mn{O_4} + {H^ + } \longrightarrow KMn{O_4} + Mn{O_2} \downarrow $View Solution
- 6નીચેનામાંથી કયુ $K _{2} Cr _{2} O _{7}$ વિશે ખોટું છે$?$View Solution
- 7$HIO_4, H_3IO_5$ અને $H_5IO_6$માં આયોડિનની ઓક્સિડેશન અવસ્થા અનુક્રમે,.....View Solution
- 8આલ્કલાઈન દ્રાવણમાં $ClO_2$ એ $H_2O_2$નું ઓક્સિડેશન કરી $O_2$ માં અને પોતાનું રિડકશન કરી $Cl^{-}$ માં રૂપાંતર કરે છે, તો એક મોલ $ClO_2 $ વડે $H_2O_2$ ના કેટલા મોલ ઓક્સિડેશન પામશે?View Solution
- 9ઓકઝેલેટની પરમેગેનેટ સાથે એસિડિક માધ્યમમાં થતી પ્રક્રિયામાં એક મોલ $CO_2$ ના ઉત્પાદન માટે કેટલા ઇલેક્ટ્રોન શામેલ હશે?View Solution
- 10$1$ મોલ સંયોજન $N_2H_4$ એ $10$ મોલ ઇલેક્ટ્રોન ગુમાવી સંયોજન $Y$ બનાવે છે. બધો જ નાઇટ્રોજન સંયોજત $Y$ માં જોવા મળે છે તેમ ધારતા સંયોજન $Y$ માં $N$ નો ઓક્સિડેશન આંક જણાવો.View Solution