\(B =5: \,1 s ^2 \,2 s ^2\, 2 p ^1\)
\(Be =4:\, 1 s ^2\, 2 s ^2\)
As we can see from the electronic configuration of \(Be\) it is having completely filled outermost shell which is highly stable whereas in \(B\) outermost shell consists of one electron which can be removed easily for attaining a stable configuration. Hence ionization energy of \(B\) is greater than the ionization energy of \(Be\).
Download our appand get started for free
Similar Questions
- 1View Solutionનીચેના માંથી ક્યો પરમાણુ ઓછી સંહસયોજક ત્રિજ્યા ધરાવે છે
- 2View Solutionઉર્જાના શોષણની આવશ્યક પ્રક્રિયા કઈ છે
- 3સંયોજનમાં ત્રણ તત્વો હોય છે $A, B$ અને $C$ ની જો ઑક્સિડેશન સંખ્યા $A= + 2, B = + 5 $અને $C = -2,$ તો સંયોજન નું સૂત્ર શું હશે ?View Solution
- 4View Solutionઆયનીય ત્રિજ્યા
- 5નીચેના તત્વોને ધ્યાનમાં લો. સમૂહ. તો $A'$, $B'$, $C'$ અને $D'$ માટે યોગ્ય વિધાન શોધો ?View Solution
$A.$ પરમાણુ ત્રિજ્યાનો ક્રમ: $\mathrm{B}^{\prime}<\mathrm{A}^{\prime}<\mathrm{D}^{\prime}<\mathrm{C}^{\prime}$
$B.$ ધાત્વીય લક્ષગનો ક્રમ: $\mathrm{B}^{\prime}<\mathrm{A}^{\prime}<\mathrm{D}^{\prime}<\mathrm{C}^{\prime}$
$C.$ તત્વનાકદનો ક્રમ: $\mathrm{D}^{\prime}<\mathrm{C}^{\prime}<\mathrm{B}^{\prime}<\mathrm{A}^{\prime}$
$D.$ આયોનીક ત્રિજ્યાનો ક્રમ: $\mathrm{B}^{\prime+}<\mathrm{A}^{\prime}+<\mathrm{D}^{\prime}+<\mathrm{C}^{\prime}+$
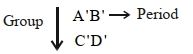
- 6નીચેના પૈકી આયનીકરણ એન્થાલ્પીનો સાચો ક્રમ ક્યો છે ?View Solution
$(i)$ $Ba < Sr < Ca$ $(ii)$ $S^{-2} < S < S^{2+}$ $(iii)$ $C < O < N$ $(iv)$ $Mg < Al < Si$
- 7તત્વોની ધરા અવસ્થા ઇલેક્ટ્રોનિક રચના ઓ $U, V, W, X,$ અને $Y$ (આ પ્રતીકોમાં કોઈ રાસાયણિક મહત્વ નથી)View Solution
$U\,\,\, 1s^2 \,2s^2 \,2p^3$
$V\,\,\, 1s^2\,2s^2 \,2p^6 \,3s^1$
$W\,\,\, 1s^2\,2s^2\, 2p^6\,3s^2\,3p^2$
$X\,\,\, 1s^2\,2s^2\,2p^6\,3s^2\,3p^6\,3d^5\, 4s^2$
$Y\,\,\, 1s^2\, 2s^2\,2p^6\,3s^2\,3p^6\,3d^{10}\, 4s^2\, 4p^6$નીચેના વિધાનોને તત્વોનો કયો ક્રમ સંતોષે છે તે નક્કી કરો:
$(i)$ તત્વ એક કાર્બોનેટ બનાવે છે જે ગરમીથી વિઘટિત નથી
$(ii)$ તત્વ સંભવિત રંગીન આયનિક સંયોજનો બનાવે છે
$(iii)$ તત્વ સૌથી અણુ ત્રિજ્યા ધરાવે છે
$(iv)$ તત્વ ફક્ત એસિડિક ઑકસાઈડ બનાવે છે - 8View Solutionનીચેનામાંથી કયો ઓક્સાઈડ ઉભયગુણી પ્રકૃતિનો હશે?
- 9$X_{g} \to X^+_{(g)} +e^-,$ $\Delta\, H = +720 \, kJ \, mol^{-1}$View Solution
વાયુમય અવસ્થામાં $'X'$ પરમાણુના $110$ મિલિગ્રામ ને $X^+$ આયનમાં રૂપાંતરિત કરવા માટે જરૂરી ઊર્જાની ગણતરી .................... $\mathrm{kJ}$ કરો. ($X$ માટે પરમાણુ વજન $= 7\, g/mol$)
- 10View Solutionઅણુના બાહ્ય કક્ષામાં ઇલેક્ટ્રોનના ઉમેરા પર પ્રકાશિત ઊર્જાની માત્રા કહેવામાં આવે છે
