જો $AB _{4}$ એ ધ્રુવીય અણુ છે તો $AB _{4}$ ની શક્ય ભૂમિતિ શું થશે ?
JEE MAIN 2020, Medium
a
\((1)\) If \(AB _{4}\) molecule is a square pyramidal then it has one lone pair and their structure should be and it should be polar because dipole moment of lone pair of \('A'\) never be cancelled by others.
\((1)\) If \(AB _{4}\) molecule is a square pyramidal then it has one lone pair and their structure should be and it should be polar because dipole moment of lone pair of \('A'\) never be cancelled by others.
\((2)\) If \(AB _{4}\) molecule is a tetrahedral then it has no lone pair and their structure should be and it should be non polar due to perfect symmetry.
\((3)\) If \(AB _{4}\), molecule is a square planar then it should be non polar because vector sum of dipole moment is zero.
\((4)\) If \(AB _{4}\) molecule is a rectangular planar then it should be non polar because vector sum of dipole moment is zero.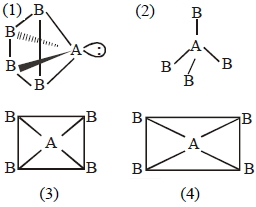
Download our appand get started for free
Experience the future of education. Simply download our apps or reach out to us for more information. Let's shape the future of learning together!No signup needed.*
Similar Questions
- 1View Solutionનીચેનામાંથી ક્યા સંયોજનમાં વિદ્યુત સંયોજક બંધ છે?
- 2$NH_3$ નું ઉત્કલન બિંદુ $PH_3$ ની તુલના માં ઊંચું છે કારણ કેView Solution
- 3સૂચિ $I$ સાથે સૂચિ $II$ ને જોડો.View Solution
સૂચિ $I$ (અણુ / સ્પીસીઝ)
સૂચિ $I$(ગુણધર્મ / આકાર)
$A$ $\mathrm{SO}_2 \mathrm{Cl}_2$ $I$ અનુયુંબકીય $B$ $NO$ $II$ પ્રતિચુંબકીય $C$ $\mathrm{NO}_2^{-}$ $III$ સમચતુષ્ફલકીય $D$ $\mathrm{I}_3^{-}$ $IV$ રેખીય નીચે આપેલા વિકલ્પોમાંથી સાચો જવાબ પસંદ કરો
- 4View Solutionહાઇડ્રોજન ફ્લોરાઈડ અન્ય હાઇડ્રોજન હેલાઈડ ની વિરુદ્ધ એક પ્રવાહી છે, કારણ કે
- 5View Solutionનીચેનામાંથી ક્યા સંયોજનમાં ધ્રુવીય અને અધ્રુવીય બંને પ્રકારના બંધો ધરાવે છે?
- 6View Solutionબહારની કક્ષકો સિવાય પરમાણુના બાકીના ભાગને ...... કહે છે.
- 7View Solutionનીચેનામાંથી ક્યા ઘનનું મહત્તમ ગલનબિંદુ છે?
- 8$HCl$ ની અવલોકેલી દ્વિધ્રુવ ચાકમાત્રા $1.303\, D$ છે. આ દર્શાવે છે કે $HCl\, 17 \%$ આયનીય અને $83 \%$ સહસંયોજક લક્ષણ ધરાવે છે. $HCl$ બંધલંબાઇ $1.26\, \mathop A\limits^o $ અને $H$ તથા $Cl$ આયનો પરના વીજભાર $+e$ અને $-e$ છે. તો ગણતરી કરેલી દ્વિઘવ ચાકમાત્રા .............. $\mathrm{D}$ થશે.View Solution
- 9ક્યા સંયોજનમાં સૌથી મોટો $H - M - H$ બંધકોણ છે?$( M = N , O , S , C )$View Solution
- 10View Solutionનીચેનામાંથી ક્યું વિધાન સાચું છે?
