Bond length is defined as the distance between two atoms that are participating in a bond.
We can also understand the bond length with the help of the $s$ character.
Higher the $s$-character lesser is the bond length.
This is because higher $s$ character implies that the electrons that are bonded pairs are closely held together, thus making the bond length small as well as strong.
Hybridisation of $C _2 H _6$ is $sp ^3$
The $s$ character in $C _2 H _6$ (Ethane) is: $\frac{1}{4} \times 100=25 \,\%$ which is the least amongst the other given compounds.
Therefore the $C - H$ bond length of $C _2 H _6$ is the longest.
Hence it is the correct option.
Download our appand get started for free
Similar Questions
- 1આપેલી પ્રકિયા માં પ્રકીયક $(A)$ શું હશે ?View Solution
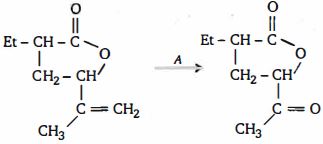
- 2View Solutionમુખ્ય નીપજ........
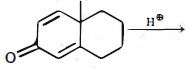
- 3${C_2}{H_5}CI\xrightarrow{{[H]}}\,x$ તો $x ...........$View Solution
- 4ટોલ્યુઇનનુ $V_2O_5$ ની હાજરીમાં હવા સાથે ઓક્સિડેશન કરતા ........... મળે છે.View Solution
- 5નીચે બે વિધાનો આપેલા છે.View Solution
વિધાન $I:$ ટ્રોપોલોન એ એક એરોમેટિક સંયોજન છે અને તે $8 \pi$ ઇલેકટ્રોનો ધરાવે છે.
વિધાન $II:$ ટ્રોપોલોન માં $ > C = 0$ સમૂહ ના $\pi$ ઈલેકટ્રોનો એ એરોમેટિકતામાં સંકળાયેલા છે.
ઉપરના વિધાનો ના સંદર્ભમાં,નીચે આપેલા વિકલ્પોમાંથી સાચો જવાબ પસંદ કરો.
- 6View Solutionસુર્યપ્રકાશની હાજરીમાં બેન્ઝિનને ક્લોરીન સાથે ગરમ કરતા કઇ નીપજ મળે છે?
- 7${{\text{C}}_{\text{6}}}{{\text{H}}_{\text{6}}}\text{ + CO + HCl }\,\xrightarrow{\text{A}}\,{{C}_{6}}{{H}_{5}}CHO\,\,+\,\,HCl\,$ ઉપર ની પ્રક્રિયામાં $\text{ }\!\!'\!\!\text{ A }\!\!'\!\!\text{ = }.......$View Solution
- 8કયા પ્રક્રિયક દ્વારા $1$-બ્યુટાઈન અને $2$-બ્યુટાઈન વચ્ચે ભેદ પારખી શકાય છે ?View Solution
- 9View Solutionવુર્ટઝ પ્રકિયામાં કેટલીક વખત મુકતમૂલકના વિઘટનને કારણે ક્યુ સંયોજન મળે છે ?
- 10View Solutionબેન્ઝિનની ક્લોરોફોર્મની ફિડલ ક્રાફટ પ્રક્રિયાથી નિપજ કઈ થશે ?
