$C$ અને $Si$ ના સ્ફટિક બંધારણ સમાન છે, બંને પાસે $4$ વેલેન્સ ઇલેક્ટ્રોન છે. પરંતુ $C$ અવાહક જ્યારે $ Si $ અર્ધવાહક તરીકે વર્તે છે, કારણ કે
AIPMT 2012, Easy
c
Electronic configuration of carbon \(\left(^{6} \mathrm{C}\right)\) is \(1 s^{2} 2 s^{2} 2 p^{2} .\)
Electronic configuration of carbon \(\left(^{6} \mathrm{C}\right)\) is \(1 s^{2} 2 s^{2} 2 p^{2} .\)
The electronic configuration of silicon \(\left(_{14} \mathrm{Si}\right)\) is \(1 s^{2} 2 s^{2} 2 p^{6} 3 s^{2} 3 p^{2}\)
Hence, the four bonding electrons of \(\mathrm{C}\) and \(\mathrm{Si}\) respectively lie in second and third orbit.
Download our appand get started for free
Experience the future of education. Simply download our apps or reach out to us for more information. Let's shape the future of learning together!No signup needed.*
Similar Questions
- 1View Solutionનીચેનામાંથી કયો સંબંધ બુલિયન ગણિત પ્રમાણે સાચો છે?
- 2$NPN$ ટ્રાન્ઝિસ્ટરમાં કલેકટર પ્રવાહ $24mA$ છે,જો $80\%$ ઇલેકટ્રોન કલેકટરમાં પહોંચતા હોય,તો બેઝ પ્રવાહ ($mA$ માં) કેટલો થાય?View Solution
- 3$P -N $ જંકશનમાં કયા કારણસર ડેપ્લેશન સ્તર રચાય છે?View Solution
- 4View Solutionઓપરેશનલ એમ્પ્લિફાયર એ
- 5View Solutionનીચેનામાંથી કયો ગેટ યુનિવર્સલ ગેટ છે.
- 6ટ્રાન્ઝીસ્ટરનો $\alpha=0.99$ ને, કોમન બેસ એમ્પ્લીફાયરમાં ઉપયોગ થાયછે. જો લોડ અવરોધ $4.5 \,k\, \Omega$ અને એમીટરનાં જંક્શનનો ડાયનેમીક અવરોધ $50\, \Omega$ હોય તો એમ્પ્લીફાયરનો વોલ્ટેજ ગેઈનView Solution
- 7View Solutionકયા પદાર્થમાં ઊર્જાનો બૅન્ડગૅપ મહત્તમ હોય છે ?
- 8રિવર્સ બાયસ સ્થિતિમાં $P - N$ જંકશનના માધ્યમમાના ડેપ્લેશન સ્તરમાં ....... હોય છે.View Solution
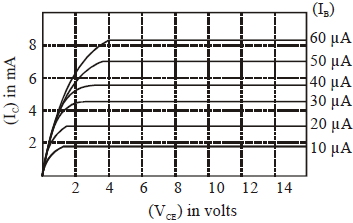
- 9ટ્રાન્ઝિસ્ટરની આઉટપુટ લાક્ષણિકતા દર્શાવેલ છે,જ્યારે $V_{C E} = 10\, V$ અને $I_{ C }=4.0\, mA ,$ હોય ત્યારે $\beta_{ ac } = .......$View Solution
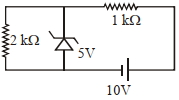
- 10નીચે આપેલ જોડાણ માટે $2\, k \Omega$ અવરોધમાં વહેતા પ્રવાહનું મૂલ્ય ............ $\times 10^{-4} A$View Solution