$\mathrm{A}+\mathrm{B} \rightarrow \mathrm{C}$
$A$ ની પ્રારંભિક સાંદ્રતા થી $1 / 4^{\text {th }}$ થવા માટે લાગતો સમય એજ પ્રક્રિયામાં $1 / 2$ થવા માટેના લાગતા સમય કરતા બમણો છે. જ્યારે $B$ ની સાંદ્રતામાં ફેરફાર વિરુદ્ધ સમયની આલેખ દોરવામાં આવે તો, પરિણામી આલેખ ઋણ ઢાળ સાથે સીધી રેખા અને સાંદ્રતા અક્ષ પર ધન આંતછેદ આપે છે. સમગ્ર પ્રક્રિયાનો ક્રમ ............ છે.
For \(1^{\text {st }}\) order reaction
\(75 \% \text { life }=2 \times 50 \% \text { life }\)
So order with respect to \(A\) will be first order.
So order with respect to \(B\) will be zero. Overall order of reaction \(=1+0=1\)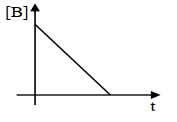
Download our appand get started for free
Similar Questions
- 1પ્રકિયા $2X + Y \to X_2Y$ નીચેની ક્રિયાવિધિને અનુસરે છે.View Solution
$2X \rightleftharpoons {X_2}$
${X_2} + Y \to {X_2}Y\,\left( {slow} \right)$
તો પ્રક્રિયાકમ જણાવો.
- 2રાસાયણિક પ્રક્રિયાનો તાપમાન આધારિત વેગ અચળાંક આર્હેનિયસ સમીકરણ $K = A.{e^{ - E^*/RT}}$ ના સ્વરૂપમાં લખાય છે. તો પ્રક્રિયાની સક્રિયકરણ ઉર્જા $({E^*})$ ............... નો ગ્રાફ દોરી ગણી શકાય છે.View Solution
- 3જો પ્રથમ ક્રમની $75 \%$ પ્રક્રિયા $90$ મિનિટમાં પૂર્ણ કરવામાં થઈ હતી, તો $60 \%$ સમાન પ્રક્રિયા પૂર્ણ થવા માટે લગભગ ........... સમય (મિનિટમાં) લાગશેView Solution
(લો: $\log 2=0.30 ; \log 2.5=0.40)$
- 4$_{92}U^{235}$ નો ક્ષય.......... ક્રમની પ્રક્રિયા છે.View Solution
- 5$700 -$ $1000\,K$ તાપમાન શ્રેણીમાં (વિસ્તાર માં) એસિટાલ્ડીહાઈડના વિઘટન માટેના દર (વેગ) અચળાંક માપવામાં આવ્યાં. $\ln k$ વિરુદ્ધ $\frac{10^{3}}{ T }$ આલેખ દોરીને માહિતીનું પૃથ્થકરણ કરવામાં આવ્યું.પ્રક્રિયા માટે સક્રિયકરણ શક્તિનું મૂલ્ય $\dots\dots\dots$$kJ\,mol { }^{-1}$ છે.(નજીકનો પૂર્ણાંક)View Solution
(આપેલ:$R =8.31\,JK ^{-1}\,mol ^{-1}$)
- 6જો પ્રક્રિયાના તાપમાનમાં $30\,K$ નો વધારો કરતા પ્રક્રિયાનો વેગ $27$ ગણો થતો હોય, તો પ્રક્રિયાનો તાપમાન ગુણાંક કેટલો થશે ?View Solution
- 7જ્યારે તાપમાન $40^{\circ} C$ થી $30^{\circ} C$માં બદલાયું ત્યારે પ્રક્રિયા વેગમાં $3.555$ ગણો ઘટાડો થયો.ત્યારે પ્રક્રિયાની સક્રિયકરણ ઊર્જા ...............$kJ\, mol ^{-1}$ છેView Solution
[લો; $R =8.314 \,J\, mol ^{-1}\, K ^{-1}$ In $3.555=1.268$]
- 8પ્રક્રિયા :View Solution
$C{l_{2(aq)}} + {H_2}{S_{(aq)}} \to {S_{(S)}} + 2H_{(aq)}^ + + 2Cl_{(aq)}^ - $ માટે વેગ $= K[Cl_2][H_2S]$ છે તો કયો તબક્કો વેગ સમીકરણ સાથે સુસંગત છે ?
$(A)$ $Cl_2 + H_2S \rightarrow H^++ Cl^- + Cl^+ + HS^-$ (ધીમો); $ Cl^+ + HS^- \rightarrow H^++ Cl^- + S$ (ઝડપી)
$ (B)$ $H_2S $ $\rightleftharpoons$ $ H^+ + HS^-$ (ઝડપી સંતુલન) ; $Cl_2 + HS^- \rightarrow 2Cl^- + H^+ + S $ (ધીમો)
- 9નીચે આપેલ માહિતી પરથી $H_2 + I_2\rightarrow 2HI$ પ્રક્રિયા માટે સક્રિયકરણ ઊર્જા .....View Solution
$T$ (in, $K$) $- 769$ , $1/T$ (in, $K^{-1}$ ) $- 1.3\times 10^{-3},$
$\log_{10}K - 2.9\,T$ (in, $K$) $- 667$, $1/T$ (in, $K^{-1}) - 1.5\times 10^{-3}$, $\log_{10}\,K - 1.1$
- 10કયું સમીકરણ $1/4^{th}$ આયુ પ્રથમ ક્રમ પ્રક્રિયા માટે આપે છે?View Solution
