આપેલ છે :
\((i)\) : \(C_6H_{6(l)} + \frac{15}{2} O_{2(g)}\) \(→\) \(6CO_{2(g)} + 3H_2O_{(l)}\)
\(\Delta H\) = \(-783\,K\,cal\)
\((ii)\) : \(C_{(s)} + O_{2(g)}\) \(→\) \(CO_{2(g)}\)
\(\Delta H\) = \(-97\,K\,cal\)
\((iii)\) : \(H_{2(g)} + \frac{1}{2} O_{2(g)}\) \(→\) \(H_2O_{(g)}\)
\(\Delta H\) = \(-68\,K\,cal\)
જેથી,
\(6CO_{2(g)} + 3H_2O_{(l)}\) \(→\) \(C_6H_{6(l)} + \frac{15}{2} O_{2(g)}\)
\(\Delta H\) = \(+783\,K\,cal\)
\(6C_{(s)} + 6O_{2(g)}\) \(→\) \(6CO_{2(g)}\)
\(\Delta H\) = \(-582\,K\,cal\)
\(3H_{2(g)} + \frac{3}{2} O_{2(g)}\) \(→\) \(3H_2O_{(g)}\)
\(\Delta H\) = \(-204\,K\,cal\)
ઉમેરવાથી,
\(6C_{(s)} + 3H_{2(g)}\) \(→\) \(C_6H_{6(l)}\)
\(\Delta H = -3\,K\,cal\)
Download our appand get started for free
Similar Questions
- 1View Solutionપ્રવાહીનું બાષ્પીભવન માટેની પ્રક્રિયા ....... થઈ પૂર્ણ થાય છે.
- 2$CaC_2$ ઉત્પન્ન કરવા $233.0\, g$ કેલ્શિયમ ઓક્સાઇડની પૂરતા પ્રમાણમાં કાર્બન સાથે પ્રકિયા થતા કેટલા .....$kJ$ ઉષ્માનો ફેરફાર થશે ?$Ca{O_{\left( s \right)}} + 3{C_{\left( s \right)}} \to Ca{C_{2\left( g \right)}} + C{O_{\left( g \right)}}\,\,;\,\Delta {H^o} = 464.8\,kJ/mol$View Solution
- 3સ્પ્રિંગના સંકોચન દરમિયાન $10\,kJ$ કાર્ય થાય છે અને $2\,kJ$ ઉષ્મા તરીકે પર્યાવરણમાં મુક્ત થાય છે. તો આંતરિક ઊર્જામાં થતો ફેરફાર $\Delta U$ ($kJ$ માં) જણાવો.View Solution
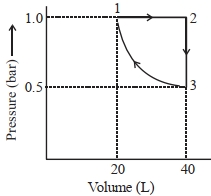
- 4એક મોલ આદર્શ એકપરમાણ્વીય વાયુને આલેખમાં દર્શાવ્યા પ્રમાણે ફેરફાર કરેલ છે. થયેલ કાર્યની માત્રા (પ્રણાલી વડે અથવા પ્રણાલી ઉપર) $..........J$ છે. (નજીકનો પૂર્ણાક) Given : $\log 2=0.3, \ln 10=2.3$View Solution
- 5નીચેના પ્રકમો પરથી પ્રકિયા $B + D \rightarrow E + 2C$ માટે $\Delta H$ નું મૂલ્ય કેટલા ........... $\mathrm{kJ/mol}$ હશે તે જણાવો.View Solution
$\Delta H \,(kJ/mol)$ $\frac 12 A \rightarrow B$ $+150$ $3B \rightarrow 2C + D$ $-125$ $E + A \rightarrow 2D$ $+350$ - 6નીચે આપેલી પ્રક્રિયા $298 \,K$ તાપમાને કરવામાં આવી.View Solution
$2NO(g) + O_2(g) \rightleftharpoons 2NO_2(g)$
$298 \,K$ તાપમાને $NO(g)$ ની પ્રમાણિત સર્જન મુક્તઊર્જા $86.6\, kJ/mol$ છે. તો $298 \,K.$ તાપમાને $NO_2(g)$ ની પ્રમાણિત સર્જન મુક્તઊર્જા કેટલી થશે ? ($K_p = 1.6 \times 10^{12})$
- 7View Solutionપ્રવાહીનું બાષ્પીભવન માટેની પ્રક્રિયા ....... થઈ પૂર્ણ થાય છે.
- 8View Solutionગેલ્વેનિક કોષમાં થતું કાર્ય એ કોના બરાબર થાય છે?
- 9સિલિન્ડરમાં $1$ વાતા. અચળ દબાણે $1.2$ લીટર $O_2$ વાયુમાં $1.0$ કિલો કેલરી ઉષ્મા ઉમેરવામાં આવે છે અને કદમાં $1.5$ લીટર ફેરફાર થાય છે. તો આ પ્રક્રિયામાં થતો આંતરિક ઊર્જાનો ફેરફારની ગણતરી ..... થશે.View Solution
- 10View Solutionઉષ્માગતિશાસ્ત્ર....... સાથે સંપર્ક ધરાવે છે.
