$C{{O}_{(g)}}+\frac{1}{2}\,{{O}_{2(g)}}\,\to \,C{{O}_{2(g)}}$ માટે ....
Easy
b
\(\Delta {{n}_{(g)}}\,\,=\,\,{{n}_{p}}\,-\,{{n}_{r}}\,\,=\,\,1\,-\frac{3}{2}\,\,=\,\,-\frac{1}{2}\,\,\,\,\,\therefore \,\,\,\,\,\Delta {{n}_{(g)}}\,<\,0\,\,\,\,\therefore \,\,\,\,\Delta H\,\,<\,\,\Delta U\)
\(\Delta {{n}_{(g)}}\,\,=\,\,{{n}_{p}}\,-\,{{n}_{r}}\,\,=\,\,1\,-\frac{3}{2}\,\,=\,\,-\frac{1}{2}\,\,\,\,\,\therefore \,\,\,\,\,\Delta {{n}_{(g)}}\,<\,0\,\,\,\,\therefore \,\,\,\,\Delta H\,\,<\,\,\Delta U\)
Download our appand get started for free
Experience the future of education. Simply download our apps or reach out to us for more information. Let's shape the future of learning together!No signup needed.*
Similar Questions
- 1$A _2+ B _2 \rightarrow 2 AB . \Delta H_f^0=-200\,kJ\,mol ^{-1} AB , A _2$ અને $B _2$ એ દ્રીપરમાણ્વિક અણુઓ છે. $A _2, B _2$ અને $AB$ બી બંંધ એન્થાલ્પીઓ $1:0.5:1$ના ગુણોત્તરમાં હોય તો, તો પછી $A _2$ ની બંંધ એન્થાલ્પી $.........\,kJ\,mol ^{-1}$ (નજીકનો પૂર્ણાક)View Solution
- 2નિર્જળ ઓકઝેલિક એસિડની દહન એન્થાલ્પી $x\,kcal\, mol^{-1}$ હોય, તો $2\, g$ ઓકઝેલિક એસિડના દહનથી ઉત્પન્ન થતી ઉષ્મા કેટલા કિલોકેલરી થશે ?View Solution
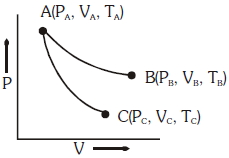
- 3આકૃતિમાં બતાવ્યા પ્રમાણે સમતાપી અને સમોષ્મી પરિસ્થિતિઓ હેઠળ આદર્શ વાયુની પ્રતિવર્તી વિસ્તરણ બતાવવામાં આવેલ છે,View Solution
$AB \to$ સમતાપી વિસ્તરણ
$AC \to$ સમોષ્મી વિસ્તરણ
તો નીચેનામાંથી કયો વિક્લપ સાચો નથી?
- 4$Br_{2(l)} + Cl_{2(g)} \rightarrow 2BrCl_{(g)}$ પ્રક્રિયા માટે એન્થાલ્પી ફેરફાર $= 30$ કિલોજૂલ/મોલ અને એન્ટ્રોપી ફેરફાર $= 105$ જૂલ/મોલ.કેલ્વિન છે, તો સંતુલને તાપમાન $= ......K$View Solution
- 5View Solutionપ્રમાણિત મુક્ત ઊર્જા ફેરફાર અને સંતુલન અચળાંક વચ્ચેનો યોગ્ય સંબંધ ...... છે.
- 6View Solutionઉષ્માગતિશાસ્ત્ર....... સાથે સંપર્ક ધરાવે છે.
- 7પ્રોપેન, ગ્રેફાઈટ અને ડાયહાઈડ્રોજનની $298 \,K$ એ દહન એન્થાલ્પી અનુક્રમે, $-2220.0 \,kJ \,mol ^{-1},-393.5 \,kJ\,mol ^{-1}$ અને $-285.8 \,kJ\, mol ^{-1}$ છે. તો પ્રોપેન $\left( C _3 H _8\right)$ ની સર્જન એન્થાલ્પીની માત્રા $......\,kJ \,mol ^{-1}$ (નજીકનો પૂર્ણાંક)View Solution
- 8$Fe + 1/2{O_2} \to FeO + x\,kcal$View Solution
$2Fe + 1/2{O_2} \to F{e_2}{O_3} + y\,kcal$ હોય, તો $Fe$ અને ઓક્સિજન માંથી$F{e_2}{O_3}$ ના સર્જનની ઉષ્મા ... થશે.
- 9$3$ -મીથાઈલબ્યુટિન અને $2$ પેન્ટીન માંટે હાઇડ્રોજનની ઉષ્મા અનુક્રમે $-30\, kcal/mol$ and $-28\,kcal/mol$ છે. $2$ -મિથાઈલબુટેને અને પેન્ટાઇનના દહનની ઉષ્મા છે - અનુક્રમે $784 \,kcal / mol$ અને $-782 \,kcal/mol$ બધા મૂલ્યો પ્રમાણભૂત શરતો હેઠળ આપવામાં આવે છે. તે ધ્યાનમાં લેતા કે બંને આલકેન્સના દહન સમાન નિપજો આપે છે, સમાન પરિસ્થિતિઓમાં નીચેની પ્રક્રિયા માટે $\Delta H$ (in $kcal/mol$) શું છે?View Solution
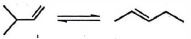
- 10View Solutionનીચેના પૈકી ક્યુ વિધાન સાચું છે ?
