Stoichiometry deals with measurements of reactants and products in a chemical reaction.
$a A(g)+b B(g) \rightarrow c C(g)+d D(g)$
Here, '$a$' moles of $A(g)$ reacts with '$b$' moles of $B(g)$ to give '$c$' mole of $C(g)$ and '$d$' moles of $D(g)$
No. of moles of $\mathrm{AgNO}_{3}=10^{-3} \mathrm{mol}$
No. of moles the chloride $=0.5 \times 10^{-3} \mathrm{mol}$
Suppose the formula for the chloride is $\mathrm{XCl}_{\mathrm{n}}$ then moles of chloride ion $=\mathrm{n} \times 0.5 \times 10^{-3}$
Reaction goes as follows:
$A g^{+}+C l^{-} \rightarrow A g C l$
Then, going by stoichiometry we get
$n \times 0.5 \times 10^{-3}=10^{-3}$
$\Rightarrow n=2$
Therefore, formula is $\mathrm{XCl}_{2}$
Download our appand get started for free
Similar Questions
- 1$6CO_2 + 6H_2O → C_6H_{12}O_6 + 6O_2$View Solution
પ્રકિયા : મુજબ $1.8$ ગ્રામ ગ્લુકોઝ મેળવવા માટે $CO_2$ ના કેટલા અણુઓની જરૂર પડશે.( $C_6H_{12}O_6$ $=180$ ગ્રામ મોલ$^{-1}$) ($C= 12$, $H =1$, $O =16$)
- 2$3.01 \times 10^{23}$ એમોનીયાના અણુઓનું વજન કેટલા .....ગ્રામ થાય છે ?View Solution
- 3$1$ લીટર પાણીમાં હાજર પરમાણુઓની સંખ્યા.....છે.. (પાણીની ઘનતા /ગ્રામ /મીલી)View Solution
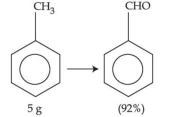
- 4ઉપરની પ્રક્રિયામાં $5\, g$ ટોલ્યુઈનનું $92\, \%$ સાથેના બેન્ઝાલ્ડીહાઈડ નીપજમાં પરિવર્તન થાય છે. ઉત્પન્ન થયેલ બેન્ઝાલ્ડીહાઈડનો જથ્થો $........\,\times 10^{-2}\, g$ છે. (નજીકના પૂર્ણાંકમાં)View Solution
- 5$CO$ ના $2.01 \times 10^{23}$ અણુઓનું વજન કેટલા.......$g$ થાય ?View Solution
- 6$1$ ગ્રામ નાઈટ્રોજનમાં હાજર અણુઓની સંખ્યા અને પરમાણુઓની સંખ્યા અનુક્રમે .....છે.View Solution
- 7એવોગેડ્રો અંક $6.022 \times 10^{23}\ mol^{-1}$ થી $6.022 \times 10^{20}\ mol^{-1},$ જેટલો ક્યારે બદલાશે.View Solution
- 8સૂચિ $I$ સાથે સૂચિ $II$ ને જોડો.View Solution
સૂચિ $I$ સૂચિ $II$ $A$ $CH _{4( g )}$ ના $16\,g$ $I$ વજન $28\,g$ $B$ $H _{2( g )}$ ના $1\,g$ $II$ $60.2 \times 10^{23}$ ઇલેક્ટ્રોન્સ $C$ $N _{2( g )}$ ના $1\,mole$ $III$ વજન $32\,g$ $D$ $SO _{2( g )}$ ના $0.5\,mol$ $IV$ $STP$ પર $11.4\,L$ કદ રોકે છે. નીચે આપેલા વિકલ્પોમાથી સાચો જવાબ પસંદ કરો.
- 9પ્રક્રીયામાં $4NH_3(g)$ + $5O_2(g) \rightarrow 4NO(g) +$ $6H_2O(g)$, જ્યારે $1$ મોલ એમોનિયા અને $1$ મોલ $O_2$ પ્રક્રીયા પૂર્ણ કરે છેView Solution
- 10નીચેની પ્રકિયા માટે $445\,g$ $C_{57}H_{110}O_6$ માંથી ઉત્પન્ન થતા પાણીનુ દળ ............. $\mathrm{g}$ જણાવો.View Solution
$2{C_{57}}{H_{110}}{O_6}(s)\, + \,163\,{O_2}(g)\, \to \,114\,C{O_2}(g)\, + \,110\,{H_2}O(l)$
