એક ઉષ્માક્ષેપક પ્રક્રિયા $X \rightarrow Y ,30 ,kJ\, mol ^{-1}$ સક્રિયકરણ શક્તિ ધરાવે છે. પ્રક્રિયા દરમ્યાન જે (શક્તિ) ઊર્જાનો ફેરફાર $\Delta E -20\, kJ$ હોય તો, પ્રતિવર્તી પ્રક્રિયા માટે સક્રિયકરણ શક્તિ $kJ$ માં ........... છે. (પૂર્ણાક જવાબ)
JEE MAIN 2021, Easy
c
\(X \longrightarrow Y\)
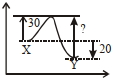
\(X \longrightarrow Y\)

Download our appand get started for free
Experience the future of education. Simply download our apps or reach out to us for more information. Let's shape the future of learning together!No signup needed.*
Similar Questions
- 1પ્રથમ ક્રમની પ્રક્રિયા $A \rightarrow$ નીપજો માટે $A$ ની સાંદ્રતા $0.1\, M$ થી $0.025\, M$ થવા $40$ મિનિટનો સમય લાગે છે. તો જ્યારે $A$ ની સાંદ્રતા $0.01\, M$ હોય ત્યારે પ્રક્રિયાનો વેગ............$\times 10^{-4}\,M/ \min$ થશે.View Solution
- 2પ્રકિયા $N_2 + 3H_2 \to 2NH_3$, માટે $d[NH_3]/dt$ નુ ક્યુ મૂલ્ય નીચેનામાંથી સાયુ છે ?View Solution
- 3પ્રથમ ક્રમની એક પ્રકિયા $15\,\min$ માં $75\%$ પૂર્ણ થાય, તો પ્રક્રિયાને $90\%$ પૂર્ણ થતા ........... $\min$ લાગશે.View Solution
- 4સંપર્ક પદ્ધતિ દ્વારા સલ્ફર ટ્રાયોક્સાઇડના સર્જનની પ્રક્રિયા $2S{O_2} + {O_2} \rightleftharpoons 2S{O_3}$ માં પ્રક્રિયાનો વેગ $\frac{{d\left[ {{O_2}} \right]}}{{dt}} = - 2.5 \times {10^{ - 4}}\,mol\,{L^{ - 1}}\,{s^{ - 1}}$ તરીકે માપવામાં આવ્યો. તો $[SO_2]$ તી સાંદ્રતાના સંદર્ભમાં $mol\,L^{- 1}\, s^{-1}$ માં પ્રક્રિયાવેગ શુ થશે ?View Solution
- 5$N_2O_5$ ના વિઘટનની પ્રક્રિયા માટે $\log\, K \to 1/T$ ના આલેખનો ઢાળ $-1.2 \times 10^4\,K$ મળે છે. તો પ્રક્રિયાની સક્રિયકરણ ઊર્જા જણાવો.View Solution
- 6પ્રક્રિયા $NH_4^+ + NO_2^- \to N_2 + 2H_2O$ માટે પ્રાયોગિક માહિતી નીચે મુજબ છે. તો પ્રકિયા માટે વેગનિયમ જણાવો.View Solution
No $[NH_4^+]$ $[NO_2^-]$ rate of reaction $1.$ $0.24\, M$ $0.10\, M$ $7.2 \times {10^{ - 6}}$ $2.$ $0.12\, M$ $0.10\, M$ $3.6 \times {10^{ - 6}}$ $3.$ $0.12\, M$ $0.15\, M$ $5.4 \times {10^{ - 6}}$ - 7$NO$ અને $Br_2$ વચ્ચેની પ્રક્રિયાથી $NOBr$ બનવાની પ્રક્રિયાની કાર્યપ્રણાલી નીચે મુજબ છે. :View Solution
$NO(g) + Br_2 (g) \rightleftharpoons NOBr_2 (g)$
$NOBr_2(g)+ NO(g)\longrightarrow 2NOBr(g)$
જો બીજો તબક્કો ધીમો તબક્કો હોય, તો $NO(g)$ ની સાપેક્ષે પ્રક્રિયા ક્રમ ........ થશે.
- 8$Kt = lnC_0 - lnC_t$ સમીકરણમાં $ t$ અને $lnC_t$ વચ્ચેનો વક્ર ..... માં હોય.View Solution
- 9$373\,K$ એ વાયુમય પ્રક્રિયા $A \rightarrow 2B + C$ પ્રથમ ક્રમની પ્રક્રિયા મળે છે. શુદ્ધ $A$ નું શરૂઆત કરતાં તે $10$ મિનિટ પછી પ્રણાલીનું કુલ દબાણ $176\,mm $ મક્યુરી અને લાંબા સમય પછી જ્યારે તે $270\,mm$ થાય છે તો ઉપરની માહિતી પરથી $(1)\,A$ નું પ્રારંભિક દબાણ $(2)\,A $ નું $10 $ મિનિટ પછીનું દબાણ $(3)$ દર અચળાંકની ગણતરી ... ....View Solution
- 10View Solutionબેઝિક માધ્યમમાં એસ્ટરનુ જળવિભાજન ........ પ્રક્રિયા છે.
