પદાર્થમાં કાર્બન $52.2\%$, હાઈડ્રોજન $13\%$, ઓક્સિજન $34.8\%$ હાજર છે અને પદાર્થની બાષ્પ ઘનતા $46$ છે. તો પદાર્થનો સૂત્ર શોધો ?
Medium
c
| પદાર્થ | % | At. Wt. | % $/$ At. wt. | Simple Ratio | Ratio |
| કાર્બન | 52.2 | 12 | 52.2/12 = 4.35 = 4.4 | 4.4/2.2 = 2 | 2 |
| હાઇડ્રોજન | 13 | 1 | 13/1 = 13 | 13/2.2 = 5.9 | 6 |
| ઑક્સિજન | 34.8 | 16 | 34.8/16 = 2.2 | 2.2/2.2 = 1 | 1 |
પ્રમાણસુચક સૂત્ર = $C_2H_6O$
પ્રમાણસૂચક દળ $= 12$ $\times$ $2 + 16 + 6 = 46$ અને અણુભાર $= 2$ $\times$ બાષ્પ ઘનતા $= 2$ $\times$ $46 = 92$
આમ, $n =$ (અણુભાર) / (પ્રમાણસૂચક દળ)
$ \Rightarrow \,\,n\,\, = \,\,\frac{{92}}{{46}} = 2$
અણુભાર = $C_2H_6O$, અણુસૂત્ર $C_4H_{12}O_2$
Download our appand get started for free
Experience the future of education. Simply download our apps or reach out to us for more information. Let's shape the future of learning together!No signup needed.*
Similar Questions
- 1વ્યાપારિક ધોરણે વેચાતો સાંદ્ર $HCl$ એ દળથી $35\%$ $HCl$ છે.જો આ વ્યાપારિક એસિડની ઘનતા $1.46\,g / mL$ હોય તો,આા દ્રાવણની મોલારિટી શું છે?View Solution
- 2એક વ્યક્તિ ચા ની મીઠાશ વધારવા $1.71$ ગ્રામ સુગર $(C_{12}H_{22}O_{11})$ ઉમેરે છે. કાર્બન પરમાણુની કેટલી સંખ્યા ઉમેરવામાં આવે છે. (સુગરનું અણુભાર $= 342$)View Solution
- 3નીચે આપેલ બંધારણ સાથે $RNA$ માં હાજર યુરેસીલ બેઇઝ છે. યુરિસિલમાં $N$ ના $\%............$ છે.View Solution
મોલર દળ $N =14\,g\,mol ^{-1} ; O =16\,g\,mol ^{-1} ; C =12\,g\,mol ^{-1} ; H =1\,g\,mol ^{-1}$;
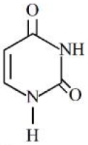
- 4નીચે આપેલ બંધારણ સાથે $RNA$ માં હાજર યુરેસીલ બેઇઝ છે. યુરિસિલમાં $N$ ના $\%............$ છે.View Solution
મોલર દળ $N =14\,g\,mol ^{-1} ; O =16\,g\,mol ^{-1} ; C =12\,g\,mol ^{-1} ; H =1\,g\,mol ^{-1}$;
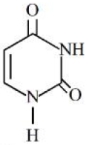
- 5$1.7$ ગ્રામ એમોનીયામાં હાજર ન્યુટ્રોનની સંખ્યા કેટલી હોય છે ?View Solution
- 6$\left({P}+\frac{{an}^{2}}{{~V}^{2}}\right)({V}-{nb})={n} {RT}$માં વાન ડર વાલ્સ વાયુ સમીકરણમાં પેરામીટર $'a'$નો એકમ છે:View Solution
- 7વિધાન:ગ્લુકોઝના એક મોલલ જલીય દ્રાવણ $1\, kg$ પાણીમાં $180\,g$ ગ્લુકોઝ ધરાવે છે.View Solution
કારણ: દ્રાવકના $1000 g$ માં એક મોલ દ્રાવ્ય પદાર્થ ધરાવતા દ્રાવણને એક મોલલ દ્રાવણ કહેવામા આવે છે.
- 8મીથાઇલ મેગ્નેશિયમ આયોડાઈડ ની $4.12\, mg$ આલ્કોહોલ સાથે $STP$ એ પ્રક્રિયા કરતાં $1.12\, ml$ વાયુ ઉત્પન્ન થાય છે તો આલ્કોહોલનું આણ્વિય દળ જણાવો.View Solution
- 9$20.8\%$ $BaCl_2$ ના $100\,mL$ દ્રાવણ ને $9.8\%$ $H_2SO_4$ ના $50\,mL$ દ્રાવણ સાથે મિશ્ર કરતા બનતા $BaSO_4$ નો જથ્થો ............. $\mathrm{g}$ જણાવો.View Solution
- 10એક ધાતુની પ્રથમ અને દ્વિતીય આયનીકરણ એન્થાલ્પી અનુક્રમે $496$ અને $4560 \;\mathrm{kJ} \mathrm{mol}^{-1}$ છે. તો આ ધાતુ હાઇડ્રોકસાઇડના $1$ મોલ સાથે સંપૂર્ણ પ્રક્રિયા કરવા $\mathrm{HCl}$ અને $\mathrm{H}_{2} \mathrm{SO}_{4}$ ના અનુક્રમે કેટલા મોલ જોઇશે ?View Solution
