\(\mathrm{K}_{\mathrm{eq}}=\frac{\mathrm{k}_{\mathrm{f}}}{\mathrm{k}_{\mathrm{b}}}=\frac{\left[\mathrm{N}_{2}\right]\left[\mathrm{H}_{2} \mathrm{O}\right]^{2}}{\left[\mathrm{H}_{2}\right]^{2}[\mathrm{NO}]^{2}}\)
At equilibrium \(\mathrm{r}_{\mathrm{f}}=\mathrm{r}_{\mathrm{b}}\)
\(\mathrm{k}_{\mathrm{f}}\left[\mathrm{H}_{2}\right][\mathrm{NO}]^{2}=\mathrm{k}_{\mathrm{b}} \frac{\left[\mathrm{N}_{2}\right]\left[\mathrm{H}_{2} \mathrm{O}\right]^{2}}{\left[\mathrm{H}_{2}\right]}\)
Hence, rate expression for reverse reaction.
\(=\mathrm{k}_{\mathrm{b}} \frac{\left[\mathrm{N}_{2}\right]\left[\mathrm{H}_{2} \mathrm{O}\right]^{2}}{\left[\mathrm{H}_{2}\right]}\)
Download our appand get started for free
Similar Questions
- 1View Solutionત્રણ પગલાની પ્રક્રિયા માટે ઉર્જાના આલેખની આકૃતિ દોરો જેમાં પ્રથમ પગલું સૌથી ધીમું અને છેલ્લું પગલું સૌથી ઝડપી છે. (ધારો કે પ્રકિયા ઉષ્માશોષક છે )
- 2$2O_3 \rightarrow 3O_2$ રાસાયણિક પ્રક્રિયા નીચે મુજબ દર્શાવી છે. તો દર નિયમ સમીકરણ..... થશે.View Solution
$ O_3 $ $\rightleftharpoons$ $ O_2 + O$ ...... (ઝડપી) ;
$O + O_3 \rightarrow 2O_2$ ...... (ધીમી)
- 3પ્રક્રિયા $A \to $ Products માં $A$ ની સાંદ્રતા મૂળ સાંદ્રતાની અડધી કરતા પ્રક્રિયાવેગ ચોથા ભાગનો થાય છે. તો પ્રક્રિયાનો કમ જણાવો.View Solution
- 4પ્રથમ ક્રમની પ્રક્રિયામાં પ્રક્રિયકની સાંદ્રતા $20$ મિનિટમાં $1.0\,M$ થી $0.25 \,M$ સુધી ઘટે છે. તો પ્રક્રિયાનો દર અચળાંક શું થશે?View Solution
- 5વાયુમય પ્રક્રિયા માટે, દર $= k [A] [B].$ જો પાત્રનું કદ ઘટીને $1/4$ પ્રારંભિક થશે તો પ્રક્રિયાનો દર પ્રારંભિક સમયમાં....... થશે.View Solution
- 6નીચેના વિશેષો માટે પ્રથમ ક્રમના તત્વો સાથે પ્રથમ વર્તુળ પ્રક્રિયા વિશેષોમાં માન્ય રેક્ટિવ હોય છે, જેમાં સ્થિર તાપમાન છે.View Solution
$\mathrm{A}+\mathrm{B} \underset{\text { Step } 3}{\text { Step } 1} \mathrm{C} \xrightarrow{\text { Step } 2} \mathrm{P}$
પ્રથમના વર્તુળ પ્રક્રિયાની માહિતી નીચે સૂચવેલી છે.
સ્ટેપ Rate constant $\left(\sec ^{-1}\right)$
Activation energy
$\left(\mathrm{kJ} \mathrm{mol}^{-1}\right)$
$1$ ${k}_1$ $300$ $2$ ${k}_2$ $200$ $3$ ${k}_3$ $\mathrm{Ea}_3$ ઉપરોક્ત રીતેની પ્રક્રિયાનું વધારણીક વર્તુળ $(k)$ આપવામાં આવે છે. $\mathrm{k}=\frac{\mathrm{k}_1 \mathrm{k}_2}{\mathrm{k}_3}$ અને ઉપરોક્ત વધારણીક તાપ $(E_2)= 400$ કેલ્વિન છે, તો $\mathrm{Ea}_3$ નું મૂલ્ય છે $\mathrm{kJ} \mathrm{mol}^{-1}$ (નજીકની પૂર્ણાંક).
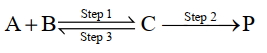
- 7$NaOH$ દ્વારા થતી સાબુની એસ્ટરીકરણ પ્રક્રિયાનો તાપમાન ગુણાંક $1.75$ છે. તો પ્રકિયાની સક્રિયકરણ ઊર્જા .......... $kcal\,mo{l^{ - 1}}$ થશે.View Solution
- 8$2X + Y \rightarrow Z + W,$ પ્રાથમિક પ્રક્રિયા માટે આણ્વીયતા.....View Solution
- 9$N_{2(g)} + 3H_{2(g)} \rightarrow 2NH_{3(g)}$ પ્રક્રિયા તાપમાનની ચોક્કસ પરિસ્થિતિ અને પ્રક્રિયકોનું આંશિક દબાણ હેઠળ થાય છે. $ NH_3$ નો નિર્માણ દર $ 0.001\,\,kg\, h^{-1}$ છે. તો $H_2$ નો રૂપાંતરણ દર તેજ સમાન પરિસ્થિતિમાં......$kg \,h^{-1}$ છે.View Solution
- 10નીચે આપેલ દર અચળાંક $(k)$ સાથે તાપમાન $(T)$ વચ્ચેનો તફાવત આલેખમાં દર્શાવ્યો છે. તો કયો આલેખ આર્હેંનિયસ સમીકરણનું પાલન કરે છે.View Solution
