(Image)
નીચે આપેલા ક્યા ગેલ્વેનિક કોષમાં થાય છે ?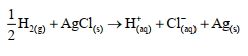
Anodic half cell
Gas - gas $1$on electrode
$\frac{1}{2} \mathrm{H}_{2(\mathrm{~g})} \rightarrow \mathrm{H}_{(\mathrm{aq})}^{+}+\mathrm{e}^{-}$
Cathodic Reaction
Metal-metal insoluble salt anion electrode
$\mathrm{Ag}_{(\mathrm{aq})}^{+}+\mathrm{e}^{-} \rightarrow \mathrm{Ag}_{(\mathrm{s})}$
$\mathrm{AgCl}_{(\mathrm{s})} \rightleftharpoons \mathrm{Ag}_{(\mathrm{aq})}^{+}+\mathrm{Cl}_{(\mathrm{aq})}^{-}$
$\mathrm{AgCl}_{(5)}+\mathrm{e}^{-} \rightarrow \mathrm{Ag}_{(\mathrm{s})}+\mathrm{Cl}_{(\mathrm{aq})}^{-}$
Overall redox reaction
$\frac{1}{2} \mathrm{H}_{2(\mathrm{~g})}+\mathrm{AgCl}_{(\mathrm{s})} \rightarrow \mathrm{H}_{(\mathrm{sq})}^{+}+\mathrm{Cl}_{(\mathrm{aq})}^{-}+\mathrm{Ag}_{(\mathrm{s})}$
Cell Representation
$\mathrm{Pt}\left|\mathrm{H}_{2(\mathrm{~g})}\right| \mathrm{kCl}_{(\mathrm{sol})}\left|\mathrm{AgCl}_{(\mathrm{s})}\right| \mathrm{Ag}$
Download our appand get started for free
Similar Questions
- 1ઔદ્યોગિક ઉત્પાદનમાં વિદ્યુત વિભાજનથી બે કલાકમાં $40$ કિ.ગ્રા. કેલ્શિયમ મળે છે. બે કલાક માટે આટલો જ પ્રવાહ પસાર કરતા કેટલા ............ $\mathrm{kg}$ એલ્યુમિનિયમ ઉત્પન્ન થાય? ($Ca$ નો પ.ભા.$= 40,\, Al = 27$)View Solution
- 2View Solutionપ્રમાણિત હાઈડ્રોજન ધ્રુવ એ શૂન્ય ધ્રુવ પોટેન્શિયલ ધરાવે છે કારણ કે. .....
- 3$298\,K$ પર, $Cu ^{2+} / Cu$ ઈલેકટ્રોડ માટે પ્રમાણિત રિડકશન પોટેન્શિયલ $0.34\,V$ છે.આપેલ : $K _{ sp } Cu ( OH )_2=1 \times 10^{-20}$ $\operatorname{Take} \frac{2.303 RT }{ F }=0.059 \,V$ લો.ઉપરના કપલ (યુગ્મ) માટે $pH =14$ પર રિડકશન પોટેન્શિયલ $(-) x \times 10^{-2}\,V$ છે.$x$નું મુલ્ય $........$ છે.View Solution
- 4આપેલ પ્રક્રિયાView Solution
$Cu(s) + 2Ag{^+}_{(aq)} \to Cu^{+2}_{(aq)} + 2Ag(s)$
માટે સંતુલન અચળાંક $K_C = 10 \times 10^{15}$ છે, તો $298\, K$ ને $E_{cell}^o$ નું મૂલ્ય કેટલુ થશે?
[${2.303\,\frac{{RT}}{F}}$ એ $298\,K$ $=0.059\,V$]
- 5જો કોષમાં $0.01 \,M$ વિદ્યુત વિભાજ્યનો અવરોધ $40$ ઓહ્મ છે. કોષ અચળાંક $0.4$ સેમી$^{-1}$ છે. તો તેમની મોલર વાહકતા ઓહ્મ$^{-1}$ સેમી$^{2}$ મોલ$^{-1}$ માં કેટલી થાય?View Solution
- 6ત્રણ ધાતુઓ $A, B $ અને$ C$ પ્રમાણિત રીડક્શન પોટેન્શિયલ અનુક્રમે $+ 0.5\, V, -3.0 \,V$ અને $-1.2\,V$ છે. આ ધાતુઓનો રીડ્યુસીંગ શક્તિનો ક્રમ એ કયો છે?View Solution
- 7View Solutionસાચું વિધાન ઓળખો.
- 8$M^{3+}/M$ વિદ્યુતધ્રુવનો પ્રમાણિત પોટેન્શિયલ શોધવા માટે નીચેનો કોષ રચાયો છે:View Solution
$Pt/ M/M^{3+}(0.001 \,mol\, L^{ -1})/Ag^+(0.01\, mol\, L^{-1})/Ag$
$298\, K$ પર સેલનો $emf$ $0.421\, volt$ હોવાનું જાણવા મળ્યું છે. $298\, K$ પર અર્ધ પ્રક્રિયા $M^{3+} + 3e \to M$ નો પ્રમાણિત પોટેન્શિયલ ......... $\mathrm{volt}$ હશે .
(આપેલ છે: $298\, K$ પર $E_{A{g^ + }/Ag}^o \,=\, 0.80\, Volt$ )
- 9$288K\, AgCl$ નાં સંતૃપ્ત દ્રાવણની વાહકતા $1.382 × 10^{-6}$ ઓહ્મ $^{-1}$ સે.મી$^{-1}$ મોલ$^{-1}$ છે. તેમની દ્રાવ્યતા $gL^{-1}$ શોધો. અનંત મંદને $Ag^{+}$ અને $Cl^{-}$ ની આયોનિક વાહકતા અનુક્રમે $61.9$ ઓહ્મ$^{-1}$ સે.મી$^{2}$ મોલ$^{-1}$ અને $76.3 $ ઓહ્મ$^{-1}$ સે.મી$^{2}$ મોલ$^{-1}$ છે.View Solution
- 10$2[Fe(CN)6]^{-3} + H_2O_2 + 2OH- \rightarrow 2[Fe(CN)_6]^{4-} + 2H_2O + O_2$ પ્રક્રિયામાં રીડકટન્ટનો તુલ્યભાર શું થશે ?$( Fe = 56, C = 12, N = 14, O = 16, H = 1)$View Solution
