Download our appand get started for free
Experience the future of education. Simply download our apps or reach out to us for more information. Let's shape the future of learning together!No signup needed.*
Similar Questions
- 1નીચેના આંકડા મુજબ, પ્રક્રિયાના એન્થાલ્પી ફેરફારની તીવ્રતાView Solution
${A}+{B} \rightarrow {M}+{N}$ $......$ ${kJ} {mol}^{-1}$ બરાબર છે. (નજીકના પૂર્ણાંકમાં)
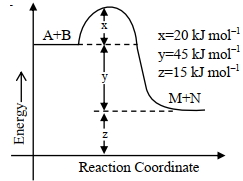
- 2જો પ્રક્રિયાના તાપમાનમાં $30\,K$ નો વધારો કરતા પ્રક્રિયાનો વેગ $27$ ગણો થતો હોય, તો પ્રક્રિયાનો તાપમાન ગુણાંક કેટલો થશે ?View Solution
- 3પ્રથમ ક્રમની એક પ્રક્રિયાની વેગ અચળાંક નીચેના સમીકરણ દ્વારા આપેલ છે.View Solution
$\ln k=33.24-\frac{2.0 \times 10^{4} \,K }{ T }$
તે પ્રક્રિયાની સક્રિયકરણ ઊર્જા $.....\,kJ\, mol ^{-1}$ થશે. (નજીકનો પૂર્ણાંકમાં)
(આપેલ છે : $R =8.3 \,J \,K ^{-1} \,mol ^{-1}$ )
- 4એક રાસાયણિક પ્રક્રિયાનો વેગ અચળાંક, પ્રક્રિયાના તાપમાનમાં $9\, K$નો વધારો કરતા બમણો માલૂમ પડયો.જો પ્રક્રિયા $300\, K$ તાપમાને થતી હોય તેમ ધારીએ તો, સક્રિયકરણ ઊર્જાનુ મૂલ્ય............$k\,J\, mol ^{-1}$ થાય. [નજીકનો પૂર્ણાંક]View Solution
(આપેલું છે$: \ln 10=2.3, R =8.3 \,J\, K ^{-1} \,mol ^{-1}, \log 2=0.30$ )
- 5View Solutionજો પ્રથમ ક્રમની પ્રક્રિયામાં વાયુમય પ્રક્રિયક અને વાયુમય નિપજો આવેલ હોય તો તેના દર અચળાંક એકમ શું હશે?
- 6View Solutionરાસાયણિક પ્રક્રિયા દરમિયાન ઉદીપકનો ઉમેરો નીચેનામાંથી કયા જથ્થામાં ફેરફાર કરે છે
- 7પ્રક્રિયા $X \rightarrow$ નીપજો એ પ્રથમ ક્રમની પ્રક્રિયા છે. જો $40$ મિનિટમાં પ્રક્રિયક $X$ ની સાંદ્રતા $0.1\,M$ થી ઘટીને $0.025\,M$ થાય તો જ્યારે પ્રક્રિયકની સાંદ્રતા $0.01\,M $ હોય ત્યારે પ્રક્રિયાનો વેગ કેટલો થશે ?View Solution
- 8$ N_2 + 3H_2\rightarrow 2NH_3 $ હેબર પ્રક્રિયા દ્વારા એમોનીયાના નિર્માણ માટે ભાગ લેતી ઉદ્દીપકીય પ્રક્રિયામાં $ NH_3 $ નો પારદર્શક દર $ 2.5 \times 10^{-4 } $ મોલ $L^{-1 }\,S^{-1 }$ છે તો $N_2$ નો અપારદર્શક દર કેટલો થશે?View Solution
- 9પ્રક્રિયા $A + B \to C$ માટેની માહિતી છેView Solution
ક્રમ.
$[A]_0$
$[B]_0$
શરૂઆતનો વેગ
$(1)$
$0.012$
$0.035$
$0.10$
$(2)$
$0.024$
$0.070$
$0.80$
$(3)$
$0.024$
$0.035$
$0.10$
$(4)$
$0.012$
$0.070$
$0.80$
ઉપરોક્ત માહિતીને અનુરૂપ વેગ નિયમ શું છે?
- 10પ્રક્રિયા $A \to $ Products માં $A$ ની સાંદ્રતા મૂળ સાંદ્રતાની અડધી કરતા પ્રક્રિયાવેગ ચોથા ભાગનો થાય છે. તો પ્રક્રિયાનો કમ જણાવો.View Solution
