$C_{12}H_{22}O_{11}+ 12O_2 → 2CO_2 + 11H_2O$ ;
$\Delta H = -5645 \,KJ$
એક દિવસમાં વપરાતા $O_2$ ના મોલ $= 640/32 = 20 \,moles$
એક દિવસમાં વપરાતા સુક્રોઝના મોલ$ = 20/12\, moles$
એક દિવસમાં વપરાતું સુક્રોઝનું દળ
$ = \,\,\frac{{20}}{{12}}\,\,\, \times \,\,342\,\,gm\,\, = \,\,570\,\,gm$
$\Delta \,\,H\,\, = \,\, - \,\,\frac{{5645\,\, \times \,\,20}}{{12}}\,\,\, = \,\, - \,9408.33\,\,KJ$
ઉત્પન્ન થતી ઉષ્મા $= 9408.33 \, kJ$
Download our appand get started for free
Similar Questions
- 1ચુનાના પત્થરમાંથી ચુનાના રૂપાંતરણમાં,$CaCO_{3(s)} \rightarrow CaO_{(s)} + CO2_{(g)} 298 \,K$ અને $1$ બાર દબાણે $ \Delta H^°$ અને $ \Delta S^°$ ના મુલ્ય અનુક્રમે $+179.1\, kJ$ મોલ$^{-1}$ અને $160.2\, J/K$ છે. $ \Delta H^°$ અને $ \Delta S^°$ તાપમાન સાથે બદલાતા નથી. ઉપરના .....$K$ તાપમાને ચુનાના પત્થરથી ચુનાના રૂપાંતરણ સ્વયંભુ રીતે થશે ?View Solution
- 2$300\, K$ તાપમાને $2\, mol$ આદર્શ વાયુનુ $5\,L$ માંથી $15\, L$ કદ માં વિસ્તરણ થાય ત્યારે થતુ કાર્ય ..............$kJ$ થશે.View Solution
- 3$300\, K$ એ એક કોષનો પ્રમાણિત ઈલેક્ટ્રોડ પોટેન્શિયલ $E^-$ અને તેના તાપમાનનો સહ ગુણાંક $\left( {\frac{{d{E^ - }}}{{dT}}} \right)$ અનુક્રમે $2\,V$ અને $-5\times10^{-4}\, V\,K^{-1}$ છે. કોષ પ્રક્રિયાView Solution
$Zn\left( s \right) + C{u^{2 + }}\left( {aq} \right) \rightleftharpoons Z{n^{2 + }}\left( {aq} \right) + Cu\left( s \right)$
$300\,K$ એ પ્રમાણિત પ્રક્રિયા એન્થાલ્પી $\left( {{\Delta _r}{H^ - }} \right),\, kJ \,mol^{-1}$ માં કેટલા .............. $\mathrm{kJ}$ થશે?
$[R=8\,J\,K^{-1}\,mol^{-1}$ અને $F=96,000\,C\,mol^{-1}]$
- 4જો કોઇ ચોક્કસ પ્રક્રિયા માટે $450\, K$ પર $\Delta_{ r } H$ એ $30\, kJ\, mol ^{-1}$ હોય તો આ જ પ્રકિયા આ જ તાપમાને સ્વયંભૂ બને તે માટે $\Delta_{ r } S$ નું મૂલ્ય $\left( J K^{-1} mol ^{-1}\right.$ માં) જણાવો.View Solution
- 5$3$ -મીથાઈલબ્યુટિન અને $2$ પેન્ટીન માંટે હાઇડ્રોજનની ઉષ્મા અનુક્રમે $-30\, kcal/mol$ and $-28\,kcal/mol$ છે. $2$ -મિથાઈલબુટેને અને પેન્ટાઇનના દહનની ઉષ્મા છે - અનુક્રમે $784 \,kcal / mol$ અને $-782 \,kcal/mol$ બધા મૂલ્યો પ્રમાણભૂત શરતો હેઠળ આપવામાં આવે છે. તે ધ્યાનમાં લેતા કે બંને આલકેન્સના દહન સમાન નિપજો આપે છે, સમાન પરિસ્થિતિઓમાં નીચેની પ્રક્રિયા માટે $\Delta H$ (in $kcal/mol$) શું છે?View Solution
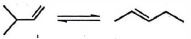
- 6નીચે બે પ્રક્રિયાઓ આપેલ છે.View Solution
$2 \mathrm{Fe}_{(\mathrm{s})}+\frac{3}{2} \mathrm{O}_{2(\mathrm{~g})} \rightarrow \mathrm{Fe}_2 \mathrm{O}_{3(\mathrm{~s})}, \Delta \mathrm{H}^{\mathrm{o}}=-822 \mathrm{~kJ} / \mathrm{mol}$
$\mathrm{C}_{(\mathrm{s})}+\frac{1}{2} \mathrm{O}_{2(\mathrm{~g})} \rightarrow \mathrm{CO}_{(\mathrm{g})}, \Delta \mathrm{H}^{\mathrm{o}}=-110 \mathrm{~kJ} / \mathrm{mol}$
$3\mathrm{C}_{(\mathrm{s})}+\mathrm{Fe}_2 \mathrm{O}_{3(\mathrm{~s})} \rightarrow 2 \mathrm{Fe}_{(\mathrm{s})}+3 \mathrm{CO}_{(\mathrm{g})}$ આપેલા પ્ર્ક્રિયા માટે એન્થાલ્પી ફેરફાર__ _ _$J/mol$ છે.
- 7જ્યારે $2$ મોલ $C_2H_6$ સંપૂર્ણ પણે સળગી $3129\, kJ$ ઉષ્મા છૂટી પાડે છે. તો $C_2H_6$ ની નિર્માણ ઉષ્મા .....$J$ થશે. $CO_2$ અને $H_2O$ ની $\Delta \,Hf$ અનુક્રમે $-395$ અને $-286 \,kJ$ છે.View Solution
- 8પ્રક્રિયામાં મુક્ત ઉર્જાનો ફેરફાર અને સંકળાયેલ સંતુલન અચળાંક $K_c$ વચ્ચેનો સાચો સંબંધ .......View Solution
- 9$C_3H_8$$_{(g)}$ + $50_2$$_{(g)}$ $\rightarrow$ $3CO_2$$_{(g)}$ + $4H_2$O$_{(l)}$ માટે $\Delta$$H$ - $\Delta$$U$ = ………View Solution
- 10એક વાયુ $1\,atm$. ના અચળ દબાણે $10\, dm^3$ માંથી $20\, dm^3$ કદમાં સમતાપી વિસ્તરણ પામે છે. જો તે પર્યાવરણમાંથી $800\, J$ ઉષ્મીય ઊર્જાનુ શોષણ કરે તો આ પ્રકમ માટે $\Delta U$ કેટલા .....$J$ થશે?View Solution
